O QUE É CORROSÃO?
A corrosão de metais pode ser definida como a transformação de um determinado metal, em sua forma metálica, em íons, pela ação da transferência de elétrons deste metal para outro elemento químico, que pode ser metal ou não.
A corrosão dos metais, principalmente, o ferro está bastante presente em nosso dia a dia, isso pode ser notado ao nosso redor, nas latarias dos automóveis, nas cadeiras metálicas, nos portões e em outras superfícies metálicas desprotegidas.
Um método de proteção, que é bastante utilizado é a pintura. A tinta, no caso da pintura dos metais é uma película que fica entre a superfície do metais e o ambiente, evitando assim, que se forme uma pilha eletroquímica entre a superfície do metal e o ambiente.
Isso é possível?
É possível uma pilha entre um metal e o ambiente?
Sim, é possível e quanto mais próximo do litoral estiver, mais real se tornará, pois a umidade presente no ar do litoral possui água do mar, que possui íons (Na+ e Cl–, principalmente), servindo assim de ponte salina da pilha eletroquímica.
Pode-se ver um exemplo de corrosão presente no nosso dia-a-dia, considerando:
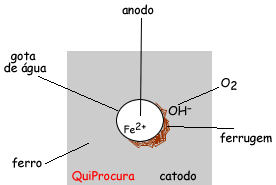 |
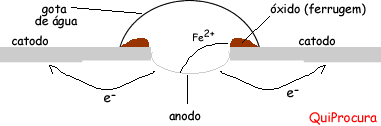 |
A partir destas figuras, temos que a superfície do metal é o catodo e o centro da gota é o anodo. Onde a gota está presente existirá a oxidação do ferro e a superfície reduzirá. Na verdade ocorrerá um fluxo de elétrons saindo do anodo e se espalhando para toda superfície metálica.
As reações ocorridas são:
Fe0 –> Fe2+ + 2e– (anodo, ocorre a oxidação do ferro)
O2 + 2H2O + 4e– –> 4OH– (catodo, redução do oxigênio para formação da hidroxila, OH–, que participará da formação do óxido)
Somando as semi-equações, teremos:
2Fe + O2 + 2H2O –> 2 Fe(OH)2
O Fe(OH)2 será oxidado à Fe(OH)3 pelo oxigênio atmosférico, pois o Fe3+ é mais estável do que o Fe2+.
Fe(OH)3 (ferrugem)
Quanto mais íons existirem na água da gota, mais fácil ocorrerá a reação. Lembre-se daponte salina.
Este é um exemplo de pilha com aplicação local, vista no cotidiano, mas não é a única, existem vários outros exemplos que poderiam ser dados, tais como: utilização de metais de sacrifício, que são metais com maior capacidade de oxidação, que são usados para evitar a corrosão dos outros metais, um exemplo de metal, que é utilizado com esta finalidade, é o magnésio, que se sacrifica pelo ferro.
As reações de eletroquímica não ocorrem somente com metais, mas também ocorrem nos processos de oxidação de plásticos, alimentos, entre tantos outros, sendo a eletroquímica bastante abrangente.
FONTE: http://quiprocura.net/wordpress/2015/06/28/corrosao/

